زُعِم خلال القرن العشرين أن الإنسان سخّر قوة الذرة. صنعنا قنابل ذرية و ولّدنا كهرباء بالطاقة النوويّة، حتى أننا قسّمنا الذرة إلى أجزاء صغيرة تسمى بالجسيمات دون الذرية (subatomic particles).
لكن ما هي بالتحديد ماهية الذرة؟ ومن ماذا صُنِعَت؟ وكيف تبدو؟ أدت متابعة دراسة بنية الذرة إلى الجمع بين العديد من أقسام الكيمياء والفيزياء في واحدة من أجمل المساهمات التي ربما قدّمها العلم الحديث. في هذه المقالة سوف نتابع هذه القصة الرائعة عن مدى تأثير الاكتشافات في مجالات العلوم المختلفة على نظرتنا المعاصرة للذرات. سوف نتابع التسلسل فى معرفة بنية الذرة وكيف ستقود تلك البنية إلي التكنولوجيات الحديثة.
ما هي الذرة؟
إرث العصور القديمة حتى القرن التاسع عشر استُخلِصَت نظرتنا المعاصرة عن الذرة من العديد من مجالات الكيمياء والفيزياء. أتت فكرة الذرة من العلوم والفلسفة اليونانية القديمة ومن نتائج كيمياء كلا القرنين الثامن عشر والتاسع عشر:
- مفهوم الذرة.
- قياسات الكتلة الذرية.
- العلاقة المكررة أو الدورية بين العناصر الكيميائية.
مفهوم الذرة
من قدماء الإغريق وحتى اليوم، تساءلنا من ماذا صُنعت المادة العادية. ولكي نفهم المُعضلة، هنا شرح بسيط من كتاب "الكيمياء الاستثنائية للأشياء العادية" (The Extraordinary Chemistry of Ordinary Things) الإصدار الثالث لمؤلفه كارل سينيدر Carl H. Snyde
- خذ مجموعة من مشابك الورق لها نفس الحجم واللون.
- اقسم تلك المجموعة إلي مجموعتين متساويتين.
- اقسم كل مجموعة من المجموعتين الصغيرتين إلى مجموعتين متساويتين.
- أعد الخطوة رقم 3 حتى تحصل على مجموعات صغيرة كلها تتألف من مشبك ورق واحد، لا يزال هذا المشبك يقوم بنفس وظيفته بمعنى أنه مازال يمكنه مسك مجموعة مفككة من الورق مع بعضه
- الآن اقطع بالمقص مشبك الورق هذا إلى نصفين، هل يستطيع أن يقوم نصف المشبك بنفس الدور الذي يقوم به المشبك الواحد الكامل؟
- لو فعلت نفس الأمر مع أي عنصر، ستصل إلى أجزاء غير قابلة للتجزيء لها نفس خصائص العنصر، كالمشبك الواحد. هذه الجزء غير القابل للتجزيء يُسمى ذرة.
لقد ابتُكِرَت فكرة الذرة للمرة الأولى على يد الفيلسوف اليونانى ديموقريطوس Democritus فى عام 530 قبل الميلاد، وفى عام 1808 قدم مدرس لغة إنجليزية وعالم يُدعى جون دالتون John Dalton مقترَحاًً للنظرية الذرّية الحديثة. وتنص النظرية الذرية الحديثة ببساطة على ما يلي:
- كل عنصر يتكون من ذرات – مجموعة من مشابك الورق.
- جميع الذرات في أي عنصر متشابهة – جميع مشابك الورق في المجموعة موحدة فى الحجم واللون.
- ذرات العناصر المختلفة متباينة فى الخصائص و الحجم – مثل مشابك الورق المختلفة في الحجم و اللون.
- تستطيع ذرات العناصر المختلفة ان تتحد مكوّنة مُركّبات جديدة.
- في التفاعلات الكيميائية، الذرات لا تُصنع ولا تُدمر ولا تتغير- لا تظهر مشابك ورق جديدة ولاتضيع ولا تتغير من لون أو حجم لآخر.
- تظل أنواع وأعداد الذرات فى أي مُركّب ثابتة - أعداد مشابك الورق النهائية وأنواعها تظل نفسها التى بدأنا بها دون تغيير.
- شكّلت نظرية دالتون الذرية العمل التحضيري الأساسي للكمياء في ذلك الوقت، تصور دالتون الذرات على شكل كُرات صغيرة عليها خطافات، وعن طريقها تستطيع الذرة أن تتحد مع أُخرى بنسب مُحددة. ولكن تستطيع بعض العناصر أن تتحد لتكوّن مُركّبات مُختلِفة (مثال: يتحد الهيدروجين مع الأكسجين ليكونا الماء أو فوق أُكسيد الهيدروجين (hydrogen peroxide) ولذلك لم يستطع أن يبت في مسألة أعداد كل ذرة داخل الجزيئات في مواد مُحددة، هل يحتوي الماء على ذرة أُكسجين مع ذرة هيدروجين أم ذرة أُكسجين مع ذرتي هيدروجين؟؟ تم حل هذه المسأل عندما عرف الكيميائيون كيفية قياس وزن الذرة.
كم تزن الذرة؟
تحققت القدرة على وزن الذرات من خلال ملاحظات صيدلاني إيطالي يُسمى أميديو أفوجادرو Amedeo Avogadro. كان أفوجادرو يعمل على الغازات (النيتروجين، الهيدروجين، الأكسجين، والكلور) ولاحظ أنه عند نفس درجة الحرارة والضغط تتحد هذه الغازات بنسب حجم محددة. على سبيل المثال:
- لتر واحد من النيتروجين يتحد مع 3 لترات من الهيدروجين ويشكل الأمونيا "غاز النشادر" (NH3) .
- لتر واحد من الهيدروجين يتحد مع لتر واحد من الكلور ويشكل كلوريد الهيدروجين (HCl).
قال أفوجادرو: "أنه عند نفس درجة الحرارة والضغط، تحتوي أحجام متساوية من غازات مختلفة على عدد متساو من الجزيئات"؛ وبناءً عليه تمكّن من تحديد نسب الكتل الذرية عن طريق وزن أحجام الغازات. فعلى سبيل المثال؛ يزن لتر الأكسجين 16 مرة من وزن لتر الهيدروجين، ووفقاً لأفوجادرو لابد أن تكون كتلة ذرة الأكسجين أكبر ب 16 مرة من كتلة ذرة الهيدروجين. أسفر هذا النوع من العمل عن مقياس الكتل النسبية للعناصر الكيمائية حيث يربط ذلك المقياس بين كتلة كل عنصر والكربون (تم اختيار نظير الكربون 12 Carbon-12) 12C كمعيار). و بمجرد إنشاء مقياس الكتلة النسبي، تمكّنت التجارب التالية من الربط بين الكتلة الذرية بالجرامات للمادة وعدد الذرات. ووُجِد أن وحدة الكتلة الذرية (Atomic mass unit) أو اختصاراً (amu) أو الدالتون Dalton) 1) دالتون تساوي \(1.66 x 10^{−24}.\)
في هذا الوقت عرف علماء الكيمياء الكتل الذرية للعناصر وخواصها الكيميائية وقفزت أمامهم ظاهرة مذهلة.
خصائص العناصر أظهرت أنماط متكررة
في الوقت الذي تم به اكتشاف الكتل الذرية للعناصر، كان عالم الكيمياء ديمتري مندليف Dimitri Mendeleev يؤلف كتاباً دراسياً. وقد بدأ كتابه بترتيب العناصر طبقاً لخصائصها وذلك بتدوين العناصر وكتلهم الذرية المُكتشفَة حديثاً على بطاقات. وترتيبب العناصر حسب الزيادة في الكتلة الذرية، ولاحظ أن العناصر التي لها خصائص مختلفة تظهر فى فترات أو دورات منتظمة.
صادف جدول مندلييف (Mendeleev’s Table) عقبتين:
- كانت هناك بعض الفراغات في الجدول الدوري (periodic table).
- عندما تمّ ترتيب العناصر حسب خصائصها، معظم العناصر كانت مرتبة حسب زيادة الكتلة الذرية فعلياً، غير أن بعض العناصر كانت خارج ذلك الترتيب.
لشرح تلك الفراغات، أرجع مندلييف تلك الفراغات للعناصر الغير مُكتَشفة بعد. في الواقع، توقّع جدوله بنجاح وجود عنصري الغاليوم (gallium) والجرمانيوم (germanium) حيث تمّ اكتشافهما لاحقاً، ورغم ذلك لم يتمكن مندلييف أبداً من تفسير خروج بعض العناصر عن الترتيب أو تفسير السلوك الدوري الذي تظهره العناصر.
سنؤجل شرح ذلك الجزء حتى نتعرف على تركيب الذرة: في الجزء التالي، سوف نرصد كيفية اكتشاف الذرة من الداخل.
بنية الذرة: علوم بدايات القرن العشرين
لتعرف تركيب الذرة لابد أن تتعرف على الآتي:
- ما هي أجزاء الذرة؟
- ما هو ترتيب تلك الأجزاء؟
حتى قُرب نهاية القرن التاسع عشر اعتُقِد أن الذرة ليست أكثر من شكل كرويّ صغير غير قابل للتجزئة (وفقاً لرأي دالتون). إلا أن سلسلة من الاكتشافات فى مجالات الكيمياء، والكهرباء، والمغناطيسية، والنشاط الإشعاعي، ومكيانيك الكم في أواخر القرن التاسع عشر وبدايات القرن العشرين غيرت كل تلك المفاهيم.
حيث ساهمت هذه المجالات بما يلي:
أجزاء الذرة:
كشفت كل من الكيمياء والكهرومغناطيسية الإلكترون أول جُسيم تحت ذري (subatomic particle).
كما أظهر النشاط الإشعاعي البروتونات والنيوترونات.
كيف تنتظم الذرة:
جمع ميكانيك الكم كل الأجزاء مع بعضها حيث أوضح الطيف الذري نموذج بور Bohr model للذرة، وأوضحت ازدواجية موجة -جسيم نموذجَ الكم للذرة.
في أواخر القرن التاسع عشر درس الكيميائيون والفيزيائيون العلاقة بين الكهرباء والمادة، حيث ثبتوا جهداً عالياً لتيار كهربائي خلال أنابيب زجاجية مملوءة بغاز ذو ضغط منخفض (زئبق، نيون، زينون) تشبه لمبات النيون، ثم وصلوا التيار الكهربائي من أحد الأقطاب (كاثود) خلال غاز إلى القطب الآخر (أنود) من خلال أشعة تُسمّى أشعة الكاثود. فى عام 1897 قام العالم البريطاني جوزيف جون طومسون J. J. Thomson بسلسلة من التجارب وحصل على النتائج التالية:
- وجد أنه إذا وضع أنبوب داخل المجال الكهربائي أو المغناطيسي، فإن أشعة الكاثود يمكن أن تنحرف أو تتحرك، وهذا ما تفعله شاشة أشعة أنبوب الكاثود cathode ray tube) CRT) خلال عمل التلفزيون.
- تمكن طومسون من قياس نسبة الشحنة الكهربائية لكتلة أشعة الكاثود وذلك عن طريق استخدام المجال الكهربائي وحده، أو المجال المغناطيسي وحده أو كلاهما معًا.
- أقر بأنه وجد نَفس نسبة الشحنة إلى الكتلة بغض النظر عن ماهية المادة التي كانت داخل الأنبوب أو التي صُنِع منها الكاثود.
خَلص طومسون إلى هذه الاستنتاجات:
- أشعة الكاثود تتكوّن من جُسيمات صغيرة سالبة الشحنة أطلق عليها اسم الإلكترونات.
- يجب أن تكون الإلكترونات قادمة من داخل ذرات الغاز أو القطب المعدني.
- لأن نسبة الشحنة للكتلة ثابتة لأي مادة، فإن الإلكترونات جزء أساسي من كل الذرات.
- لأن نسبة الشحنة للكتلة عالية جداً، يجب أن يكون الإلكترون صغيراً جداً.
في وقت لاحق قام فيزيائي أميركي يُسمّى روبرت ميليكان Robert Milikan بقياس الشحنة الكهربائية للإلكترون. وبالحصول على هذين الرقمين (الشحنة الكهربائية للإلكترون، والنسبة بين الشحنة الكهربائية والكتلة للإلكترون) قدر الفيزيائيون كتلة الإلكترون بـ \(9.10 x 10^{-28}\) جرام. وعلى سبيل المقارنة فإن كتلة البنس تعادل 2.5 جرام أي أن \(2.7 x 10^{27} \) أو 2.7 مليار مليار مليار إلكترون يُعادل وزن البنس.
وتم الوصول إلى نتيجتين من اكتشاف الإلكترون:
- لأن شُحنة الإلكترون سالبة والذرة متعادلة كهربياً، فهذا يعني بالضرورة وجود شحنة موجبة في مكان ما في الذرة.
- لأن الإلكترون أصغر كثيراً من الذرة، فهذا يعني بالضرورة وجود جُسيمات أُخرى أكثر ضخامة في الذرة.من هذه النتائج طرح طومسون نموذجاً للذرة يُشبه البطيخة حيث يمثّل الجزء الأحمر الشُحنة الموجبة وتمثل البذور الشحنة السالبة.
ملاحظات:
- جُسيم دون ذري: الجسيمات دون الذرية هي التي تكون ذات أحجام أصغر من الذرة، من هذه الجسيمات البروتونات والإلكترونات والنيترونات التي تتكوّن منها الذرة
- ميكانيكا الكم: فرع من الفيزياء يتعامل مع حركة الجُسيمات حسب الخصائص الموجية فى المستوى الذري ودون الذري. (من المقال)
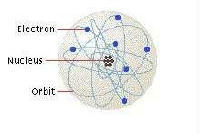
- نموذج بور للذرة: نموذج يصور الذرة كنواة صغيرة موجبة الشحنة محاطة بالإلكترونات الموجودة في مدارات - وذلك مثل النظام الشمسي.
- ازدواجية موجة-جُسيم: خاصية مميزة للجسيمات الأولية والكمّية تمكنها من التصرف في بعض الأحيان كموجة وفي البعض الآخر كجُسيم.
النشاط الإشعاعي: اكتشاف النواة، والبروتون، والنيوترون
في نفس الوقت تقريباً الذي أجرى فيه طومسون تجربته على أشعة الكاثود، درس فيزيائيون مثل هنري بيكريل Henri Becquerel، وماري كوري Marie Curie، و بيير كوري Pierre Curie، و إرنست رذرفورد Ernest Rutherford النشاط الإشعاعي. وُصِف النشاط الإشعاعي بثلاثة أنواع من الأشعة المنبعثة ( لمزيد من التفاصيل تابع كيفية عمل النشاط الإشعاعي):
- جُسيمات ألفا: موجبة الشُحنة وثقيلة. أوضح إرنست رذرفورد أن هذه الجُسيمات كانت نواة ذرة الهيليوم.
- جُسيمات بيتا: سالبة الشُحنة وخفيفة (اتضح فيما بعد أنها كانت الإلكترونات).
- أشعة غاما: متعادلة الشُحنة وليس لها كُتلة ( أي أنها طاقة )
ساهمت تجربة النشاط الإشعاعي في معرفتنا الحالية لمعظم المعلومات عن تركيب الذرة من قِبَل رذرفورد وزملائه. أطلق رذرفورد شعاعاً من جُسيمات ألفا نحو رقاقة من الذهب، وبحث عن حزم الأشعة على شاشة الفلوروسنت، فلاحظ الآتي:
- مُعظم الجُسيمات عَبَرت الرقاقة باستقامة وضربت الشاشة.
- بعض الجُسيمات (0.1%) انحرفت أو تفرّقت (بزوايا متعددة) أمام الرقاقة، بينما تفرّقت باقي الجُسيمات خلف الرقاقة.
استنتج رذرفورد أن ذرات الذهب كانت تقريباً مساحة فارغة حيث سمحت لجُسيمات ألفا أن تعبر خلالها. إلا أنه لا بد أن يكون يكون لمنطقة صغيرة من الذرة كثافة كافية لتحرف جزيئات ألفا عن مسارها أو تبعثرها. وقد سمّى تلك المنطقة الكثيفة بالنواة (انظر تجربة رذرفورد وهي محاكاة ممتازة لهذه التجربة الهامة!)، تضُم النواة معظم كتلة الذرة. لاحقاً عندما قصف رذرفورد النيتروجين بجزيئات ألفا، انبعث جُزيء/جُسيم موجب الشحنة أخف من جزيئات ألفا، سمّى هذه الجُسيمات بالبروتونات، و أدرك أنها جزء أساسي فى النواة. تُقدّر كتلة البروتون بـ \(1.673 x 10^{-24}\) جرام أي أكبر من كتلة الإلكترون بحوالي 1.835 مرة. ومع ذلك يمكن أن تكون البروتونات ليست هي الجُسيم الوحيد الموجود فى النواة، لأن عدد البروتونات فى أي عُنصر مُحدد (بواسطة الشحنة الكهربية) كان أقل من وزن النواة. وعلى ذلك توجّب وجود جُسيم ثالث متعادل الشُحنة. وقد اكتشف الفيزيائي الإنجليزي زميل رذرفورد، جيمس تشادويك James Chadwick، ذلك الجُسيم دون الذري الثالث (النيوترون). حيث قصف تشاوديك رقاقة البيريليوم (Be) بجُسيمات ألفا ولاحظ خروج إشعاع مُتعادل. هذا الإشعاع المتعادل يمكنه إقصاء البروتونات خارج أنوية مواد أخرى. استنتج تشادويك أن هذا الإشعاع كان تياراً من جُسيمات متعادلة الشحنة تحمل تقريباً نفس كتلة البروتون، حيث تعادل كتلة النيوترون \(1.675 x 10^{-24} \)جرام.
هذه هي الأجزاء المعروفة من الذرة، ولكن كيف تم ترتيبها لتكوين الذرة؟؟
أوضحت تجربة رقاقة الذهب لرذرفورد أن النواة كانت في مركز الذرة وأن الذرة كانت تقريباً فضاء فارغاً. وعلى ذلك فقد تصوّر رذرفورد الذرة كنواة موجبة الشُحنة في المركز تدور حولها الإلكترونات سالبة الشُحنة، تشبه كوكب وحوله أقمار. وبالرغم من أنه لم يمتلك دليلاً على دوران الإلكترونات حول النواة، إلا أن نموذجه بدا منطقياً، لكنه مثّل مشكلة، لأن الإلكترونات تتحرك فى حركة دائرية، بالتالي تفقد طاقة وتبثُ ضوء. وحيث أنّ فقدان الطاقة يُبطِئ حركة الإلكترونات كأي قمر صناعي، فإن الإلكترونات المُبطّئة ستقع في النواة. فى الواقع حُسِب وفقاً لما سبق أن ذرة رذرفورد ستستمر فقط لعدة مليارات من الثانية قبل أن تنهار! شيء ما كان مفقوداً!!
ميكانيكا الكم: جمع كل الأمور معاً
في نفس الوقت الذي كانت تتم فيه الاكتشافات من خلال النشاط الإشعاعي، كان الفيزيائيون والكيميائيون يدرسون كيفية تفاعل الضوء مع المادة. هذه الدراسات بدأت مجال ميكانيكا الكم، وساعدت في حل بِنية الذرة.
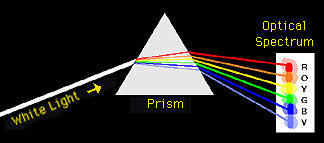
ميكانيكا الكم تسلط الضوء على الذرة: نموذج بور (Bohr Model) درس الفيزيائيون والكيميائيون طبيعة الضوء الذي ينبعث عند مرور تيارات كهربائية خلال أنابيب تحتوي على عناصر غازية (هيدروجين، هيليوم، نيون)، وعند تسخين العناصر (على سبيل المثال: الصوديوم، البوتاسيوم، الكالسيوم، وما إلى ذلك) على لهب. مَرروا الضوء المُنبعث من تلك المصادر خلال مطياف (spectrometer) (جهاز يحتوي على فتحة ضيقة موشور زجاجي).
عند تمريرك لضوء الشمس خلال موشور زجاجي، ستحصل على طيف متواصل من الألوان مثل قوس قزح. إلا أنّه عندما مرّ الضوء المنبعث من تلك المصادر المختلفة السابق ذكرها خلال الموشور الزجاجي، وجدوا أنّ كل عنصر له طيف مُميّز وأن الطول الموجي لكل خط فى الطيف له طاقة محددة (لمزيد من التفاصيل عن العلاقة بين الطول الموجي والطاقة، انظر في كيف يعمل الضوء)
في عام 1913، جمع الفيزيائي الدنماركي نيلس بور Niels Bohr نتائج رذرفورد مع الأطياف المرصودة من أجل التوصّل لنموذج جديد للذرة في نقلة حقيقية من الإلهام، اقترح بور أنّ الإلكترونات التي تدور حول الذرة يمكن فقط أن تتواجد في مستويات طاقة محددة (بمعنى أبعاد) من النواة، وليست فى مستويات متّصلة كما كان متوقعاً في نموذج رذرفورد. عندما امتصت الذرات في أنابيب الغاز الطاقة من التيار الكهربائي، أصبحت الإلكترونات مُثارة وانتقلت من مستويات الطاقة المنخفضة (القريبة من النواة) إلى مستويات الطاقة العالية (الأبعد عن النواة). ولأن الإلكترونات المُثارة تريد أن تعود لمستويات طاقتها الأصلية تنبعث منها طاقة على شكل ضوء. ونظراً إلى أن هناك اختلافات مُحددة بين مستويات الطاقة، فإن موجات طولية محددة هي فقط التي تُرى فى الطيف (بمعنى تُرى كخطوط).
كانت الميزة الأساسية لنموذج بور، أنه نجح عملياً، وأوضح عدة أمور:
الطيف الذري - نُوقِش أعلاه
السلوك الدوري للعناصر: إن العناصر ذات الخواص المُتشابهة لها أطياف ذرّية متشابهة
- كل مدار إلكتروني له نفس الحجم ونفس مستوى الطاقة، يستطيع فقط أن يحمل عدداً من الإلكترونات. على سبيل المثال المستوى الأول للطاقة يمكن أن يحمل إلكترونين، والثاني يمكن أن يحمل ثمانية إلكترونات، والثالث يمكن أن يحمل ثمانية عشر إلكتروناً، والرابع يمكن أن يحمل 32 إلكتروناً، وهكذا حتى المستوى السابع من الطاقة.
- عندما يمتلئ مستوى طاقة، تتواجد الإلكترونات فى المستويات الأعلى.
- ارتكزت الخصائص الكيميائية على عدد الإلكترونات في المستويات الخارجية للطاقة، العناصر ذات المستويات الخارجية الممتلئة بالحد الأقصى من الإلكترونات لا تتفاعل، بينما العناصر الأُخرى تأخذ إلكترونات أو تمنحها لتحصل على غلاف خارجي يحتوي على الحد الاقصى من الإلكترونات.
إذاً إن نموذج بور ساعد أيضاً في شرح سلوك أشعة الليزر بالرغم من أن هذه الأجهزة لم يكُن قد تمّ اختراعها بعد.
كان نموذج بور هو النموذج السائد حتى ظهور الاكتشافات الجديدة في ميكانيكا الكم.
ملاحظات:
المطياف: المطياف في الفيزياء هو جهاز لقياس الطيف، وفى العموم الطيف هو مخطط بياني يُبين الشدة كتابع للطول الموجي، أو التردد، أو الطاقة، أو العزم، أو الكتلة يُمكن للإلكترونات أن تتصرف كموجات: النموذج الكمومي للذرة على الرغم من أن نموذج بور شرح كيفية عمل الطيف الذري شرحاً كافياً، إلا أنّه كانت هناك العديد من التساؤلات التي أرّقت الفيزيائيين والكيميائيين كالآتي:
- لماذا يجب أن تنحصر الإلكترونات فقط في مستويات طاقة مُحددة؟
- لماذا لا تبثّ الإلكترونات الضوء طوال الوقت؟ فعندما تغيّر الإلكترونات اتجاهها في مدارتها الدائرية (أي تسرع حركتها)، يجب أن تبث ضوءاً.
- يمكن أن يفسّر نموذج بور الأطياف الذرية لإلكترون واحد في المستوى الخارجي تفسيراً جيداً، إلا أنه غير جيد بشكل كافٍ في التعامل مع تلك التي يحوي مستوى طاقتها الخارجي أكثر من إلكترون.
- لماذا بإمكان مستوى الطاقة الأول أن يتسع لإلكترونين فقط، بينما يتسع كل مستوى يليه لثمانية إلكترونات؟ من الواضح أن نموذج بور افتقر لشيء ما.في عام 1924 اقترح فيزيائي فرنسي يُدعى لويس دي برولي Louis de Broglie أن الإلكترونات مثل الضوء، أي يمكن أن تسلك كِلا السلوكين؛ سلوك الجسيمات وسلوك الموجات (لمزيد من التفاصيل تابع الطور الموجي بالرسوم المتحركة لدي برولي) تأكدت فرضيات دي برولي بالتجارب التي أوضحت أن أشعة الإلكترون يمكن أن تحيد أو تنحني كما يحدث للضوء عند مرورها خلال شق طولي. لذا فإن الموجات التي يبثها الإلكترون تكون منحصرة فى مدارها حول النواة مُطلِقه [6] موجة مستقرة (standing wave) ذات طول موجي وطاقة، وتردد (أي مستويات الطاقة لبور) محدد، تشبه إلى حد كبير أوتار الجيتار التي تُطلق موجة مستقرة عند العزف عليها.
تبع فكرة دي برولي تساؤل آخر. لو تحرك إلكترون كموجة، فهل يمكن تحديد الموضع الدقيق للإلكترون داخل الموجة؟ أجاب الفيزيائي الألماني فيرنر هايزنبيرج Werner Heisenberg بالنفي، فيما أسماه بمبدأ عدم التأكد أو مبدأ الريبة (uncertainty principle):
- لتشاهد الإلكترون في مداره يجب أن تصوّب عليه ضوءاً ذا طول موجي أقصر من الضوء الطول الموجي للإلكترون.
- هذا الطول الموجي الصغير للضوء له طاقة عالية.
- سيمتص الإلكترون هذه الطاقة.
- الطاقة المُمتصة ستغيّر موقع الإلكترون.
لا يُمكننا أبدًا معرفة كل من زخم الإلكترون وموقعه في الذرة على حد سواء لهذا قال هينزنبرج: "لا يجب أن نعرض الإلكترونات وكأنها تتحرك فى مدارات محددة تمامًا حول النواة".
آخذاً كلاً من فرضيّة دي براولي ومبدأ الارتياب لهاينزبرج في الاعتبار؛ اشتقّ الفيزيائي النمساوي إرفين شرودنجر Erwin Schrodinger في عام 1926 مجموعة من المعادلات أو الدوال الموجية للإلكترون. وفقاً لشرودنجر فإن الإلكترونات المنحصرة فى مداراتها، تُطلق موجات مستقرة، وبإمكانك فقط أن تصف احتمالية تواجد الإلكترون. توزيع هذه الاحتمالات يكوّن مناطق من الفراغ حول النواة سُمّيت بالمداريّات أو الأوربيتالات (orbitals). يمكن وصف الأوربيتالات/ المداريّات كسُحب إلكترونية كثيفة (لمزيد من التفاصيل انظر فى الأوربتالات/ المداريّات الذريّة والجزيئية لمعرفة الأوربتالات/ المداريّات المختلفة). المنطقة الأكثر كثافة فى السحابة هي تلك المنطقة ذات الاحتمال الأكبر لوجود الإلكترون، والمنطقة الأقل كثافة هي تلك المنطقة ذات احتمال الأضعف للعثور فيها على إلكترون.
[8]الدوال/التوابع الموجية (Wave Functions):
يمكن وصف الدالة/التابعة الموجية لكل إلكترون كمجموعة من ثلاثة أعداد كمومية (quantum numbers):
- عدد كم رئيسي (Principal number) ويرمز له بالرمز (n): يصف طاقة الإلكترون.
- عدد كم ثانوي او مداري (Azimuthal number) ويرمز له بالرمز (I): يصف مدى سرعة تحرُّك الإلكترون في مداره أي [10] الزخم الزاوي أو كمية الحركة الزاوية (angular momentum) مثل مدى سرعة دوران قرص مضغوط (CD) (دورة في الدقيقة)، ويتعلّق هذا بشكل الأوربتال/المدار.
- عدد الكم المغناطيسي (magnetic quantum number) ويرمز له بالرمز (m): يحدد توجهه في الفضاء.و اقتُرِحَ لاحقاً أنه لا يمكن لإلكترونين التواجد في نفس الحالة ، لذلك أُضِيف عدد كمومي رابع. يتعلق هذا العدد بالاتجاه الذي يدور فيه الإلكترون حول محوره أثناء دورانه في مداره/ أوربتاله (أي باتجاه عقارب الساعة أو عكس اتجاه عقارب الساعة). يمكن لإلكترونين اثنين فقط أن يتشاركا نفس المدار، أحدهما يتحرك حول محوره باتجاه عقارب الساعة والآخر يتحرك عكس اتجاه عقارب الساعة.
للأوربتالات/ المدريّات أشكال مختلفة وحد أقصى لكل مستوى:
- الشكل الواضح (S) كروي، الحد الاقصى= 1
- الشكل الرئيسي (P) شكل الجرس المصمت، الحد الأقصى= 3
- الشكل المُدمج (D) شكل رباعي الفلقات، الحد الأقصى= 5
- الشكل الأوّلي (F) شكل سداسى الفلقات، الحد الأقصى= 7 اشتُقّت أسماء المداريّات من أسماء معالم الأطياف الذرّية وذلك قبل اختراع ميكانيكا الكم رسمياً. يمكن لكل مدار/ أوربيتال أن يحوي فقط إلكترونين كما أن المداريات تتبع ترتيباً معيناً في ملء الإلكترونات، بشكل عام هناك بعض التداخل (تابع أي كتاب كيمياء يحتوي تفاصيل التداخل بين الإلكترونات).
يُسمى النموذج الناتج من الذرات بالنموذج الكمومي للذرات.
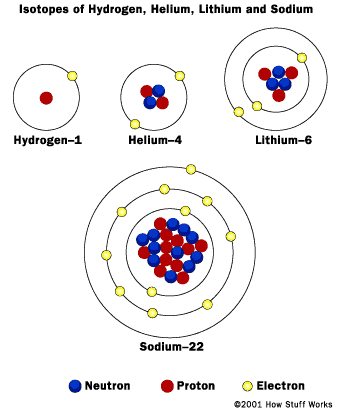
لعنصر الصوديوم 11 إلكترون موزعة في مستويات الطاقة الآتية:
- مدار s واحد: 2 إلكترون.
- مدار s واحد : 2 إلكترون، وثلاثة مداريات (P2 إلكترون لكل واحد منهم).
- مدار s واحد: إلكترون واحد.
حتى الآن يُعتبر النموذج الكمومي هو الرؤية الأكثر واقعية للتركيب الإجمالي للذرة حيث أنه يُفسّر الكثير مما نعرفه في الكيمياء والفيزياء، هنا بعض الأمثلة:
- الكيمياء: الجدول الدوري، يعكس نمط وترتيب الجدول ترتيب الإلكترونات في الذرة. تمتلك العناصر أعداد ذرية مُختلفة. عدد الإلكترونات أو البروتونات يزداد أعلى الجدول حيث تملأ الإلكترونات الأغلفة الخارجية . للعناصر أعداد كتلية مختلفة، حيث يزداد أعلى الجدول حاصل مجموع عدد البروتونات مع عدد النيوترونات. العناصر الموجودة في نفس الصف لها نفس عدد مستويات الطاقة (الأغلفة الخارجية). العناصر الموجودة في نفس العمود من الجدول الدوري يكون لها جميعاً نفس عدد الإلكترونات في مستوى أو غلاف الطاقة الخارجي (من إلكترون إلى ثمانِ إلكترونات).
- التفاعلات الكيميائية: تبادل الإلكترونات بين ذرات مختلفة (أخذ أو منح أومشاركة ). تبادل الإلكترونات يشمل الإلكترونات الموجودة في المستوى الخارجي للطاقة في محاولة لملء الغلاف الخارجي (أي محاولة الحصول على الشكل الأكثر استقراراً للذرة)
- النشاط الإشعاعي الفيزيائي: تبثّ التغيرات فى النواة (بمعنى الاضمحلال) جزيئات نشطة إشعاعياً.
- المفاعلات النووية (Nuclear reactors): انقسام نواة (الانشطار).
- القنابل النووية (Nuclear bombs): انقسام نواة (الانشطار) أو تكوين نواة (الاندماج)
- الأطياف الذرية: تحدث نتيجة تغير الإلكترونات المثارة لمستويات الطاقة (امتصاص الطاقة أو انبعاثها على شكل [11] فوتونات ضوئية (light photons))
ملاحظات:
[6] موجة راكدة أو ساكنة: هي موجة ذات وضعية ثابتة. تنشأ هذه الظاهرة إما بسبب الوسط المعاكس لحركة الموجة أو في الوسط الساكن نتيجة تداخل بين موجتين متعاكستين في الاتجاه.
[7] مبدأ عدم التأكد أو مبدأ الريبة: يقر هذا المبدأ على أنه لا يمكن أبداً تحديد خاصيتين قياسيتين معاً بدقة مثل سرعة و مكان جسيم، فإما تحديد سرعة الجسيم أو مكانه، أي أن تحديد أحد الخاصيتين بدقة متناهية يتبعه عدم تأكد كبير في قياس الخاصية الأخرى، (شرح للمبدأ وليس نصه)
[8] الدوال الموجية: دالة موجية مرافقة لكل جسيم حسب التصور الموجي الذي قدمه شرودنغر، وتقوم هذه الدالة الموجية بتحديد احتمال وجود الجسيم في أي نقطة من الفراغ التي يمكن للجسيم التواجد فيها. الموجة هي أداة لوصف الجسيمات وحركتها وتآثرها مع جسيمات أخرى مثل الذرة أو نواة الذرة. (الشرح من ويكيبيديا)
[9] أعداد الكم: مجموعة من القيم العددية التي تُعطي حلولاً مقبولة للمعادلة الموجية لشرودنجر لذرة الهيدروجين- هي إحداثيات الإلكترون في الذرة، هي أعداد تحدد أحجام الحيز من الفراغ الذي يكون احتمال تواجد الإلكترونات فيه أكبر، كما تحدد طاقة الأوربتالات (مدارات) وأشكالها واتجاهاتها بالنسبة لمحاور الذرة في الفراغ، ويلزم لتحديد طاقة الإلكترون في الذرة معرفة قيم الأربعة أعداد الكمية التي تصفه (الشرح وفقًا لويكبيديا)
[10] الزخم الزاوي أو كمية الحركة الزاوية: هو قيمة متجهة لقياس مدى توجيه الزخم الخطي بالنسبة لنقطة اختيارية تدعى المركز (التعريف وفقاً لويكيبيديا)
[11] فوتونات (الفوتون): جسيم أولي عديم الشحنة،عديم الكتلة، ينتقل بسرعة الضوء، له خاصية ازدواجية موجة- جُسِيم.
ينشأ الفوتون عند انتقال أحد إلكترونات الذرة من مستوى طاقة مرتفع لمستوى طاقة منخفض تحت تأثير خارجي كالحرارة.
فالفوتونات عبارة عن أشعة كهرطيسية، بعضها يمكن رؤيته وينتمي إلى أشعة الضوء المرئي، والبعض الآخر يمكن أن يظهر في هيئة شعاع من الأشعة السينية ذات الطاقة العالية وبالتالي لها درجة نفاذ عالية. وتنشأ الأشعة السينية عندما يقفز إلكترون من مستوى عالٍ في الذرة إلى مستوى طاقة منخفض في الذرة بالقرب من النواة.
أيمكننا أن نرى الذرة؟
الذرات صغيرة جداً لدرجة أنه لا يُمكن رؤيتها بالعين المجردة .لنُعطيك شعوراً ببعض الأحجام، هذه هي الأقطار التقريبية لذرات وجزيئات مُختلفة:
- قُطر الذرة= \(1 x 10^{-10}\) متر
- قُطر النواة= من \(1 x 10^{-15}\) إلى \(1 x 10^ {-14}\) متر
- قُطر النيوترون أو البروتون=\( 1 x 10^{-15}\) متر
- قُطر الإلكترون لم يُعرف تحديدًا ولكن يُعتقد أنه في حدود \(1 x 10^{-18}\)
لا يمكنك أن ترى ذرة بالمجهر الضوئي (light microscope) إلا أنه في عام 1981 تمّ تطوير نوع من الميكروسكوبات يُسمى مِجهَر مسح نفقي (scanning tunneling microscope) أو اختصاراً (STM) . ويتكون مِجهَر المسح النفقي من الآتي:
- جهاز مسح كهروضغطي (كهربائي-انضغاطي) سريع، حيث يُثبّت الطرف.
- مكونات إلكترونية لمد الطرف بالتيار الكهربي، وللتحكّم في جهاز المسح، ولتلقي الإشارات من مستشعر الحركة.
- جهاز حاسوب للتحكّم في النظام والقيام بتحليل البيانات (جمع البيانات ومعالجتها وعرضها).
يعمل مِجهَر المسح النفقي (STM) كالآتي:
- يُمد التيار الكهربائي للطرف (المنظار) في أثناء تحريك جهاز المسح للرأس بسرعة عبر سطح العينة المُوصّلة.
- عندما يصادف المنظار ذرة، يتغير تدفق الإلكترونات بين الذرة والمنظار.
- يسجل الحاسوب التغيير فى التيار الكهربائي فى الموضع (X) و (Y) للذرة.
- يستمر جهاز المسح في وضع المنظار أعلى كل نقطة (X) و (Y) على سطح العينة مسجلاً التيار الكهربائي عند كل نقطة.
- يجمع الحاسوب البيانات ويرسم خريطة للتيار المار على السطح، والتي تُطابق خريطة المواقع الذرية.
هذه العملية تُشبه الفونوغراف القديم حيث تكون الإبرة هي الطرف والحفرات في الفونوغراف هي الذرات. يتحرك طرف مجهر المسح النفقي أعلى المُحيط الذري للسطح، مُستخدماً أنبوب التيار الكهربائي ككاشف حساس للموقع الذري.
مكننا مجهر المسح النفقي والتنوعات الجديدة لهذا المجهر من رؤية الذرات. بالإضافة إلى ذلك فإن مجهر المسح النفقي يمكن استخدامه في التحكم بالذرات كما هو موضح هنا:

يمكن نقل الذرات وتشكيلها لعمل أجهزة متنوعة مثل المحركات الجزيئية (molecular motors) (لمزيد من التفاصيل تابع كيف ستعمل تقنية النانوتكنولوجي) بإختصار: فقد كشف العلم فى القرن العشرين عن بنية الذرة. ويُجري العلماء حالياً تجارب لكشف تفاصيل بنية النواة والقوى التي تُثبّتها معاً.
ملاحظات:
[12] مِجهَر مسح نفقي: تبلغ قوة تكبيره حوالي مئة مليون مرة، ويتصل به حاسوب يعمل على تحليل المعلومات الواردة إليه ليظهر صورة العينة بأبعادها الثلاثة.
[13] الفونوغراف أو الجرامافون: هو أول جهاز استخدم لتسجيل واستعادة الصوت.