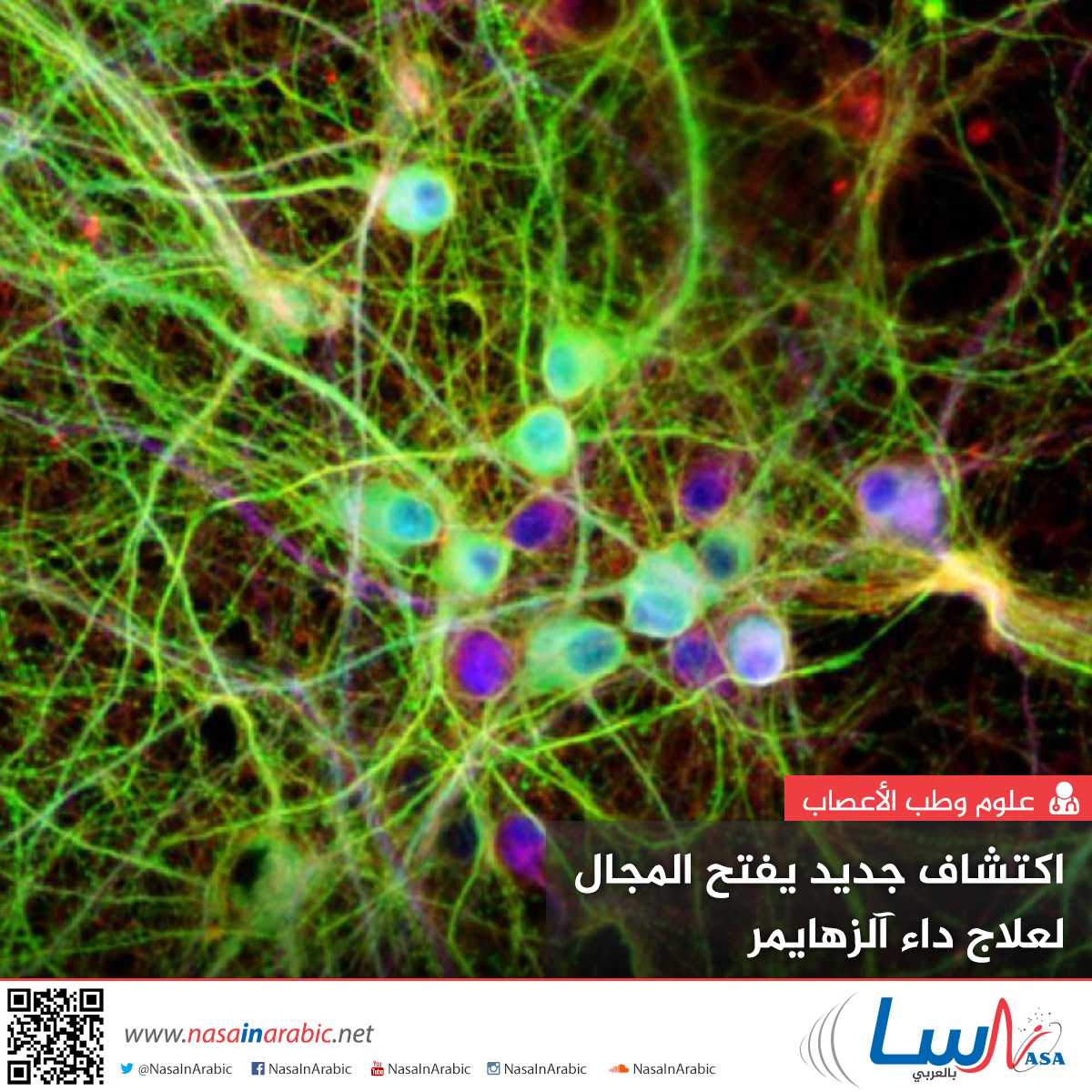
هذه صورة لعصبونات في أطباق الزرع، يَظهر بروتين تاو tau البشري ملوَّنًا بالأخضر، بينما تظهر المكونات البنيوية ملوَّنة بالأحمر والDNA داخل نواة الخلية بالأزرق.
حقوق الصورة UNSW/Lars Ittner
سلط باحثون أستراليون الضوء من جديد على عمليات الخلايا العصبية التي تؤدي لداء آلزهايمر (Alzheimer’s Disease) مغيرين بذلك الأفكار السابقة عن كيفية تطور المرض، مما فتح المجال أمام خيارات علاجية جديدة من الممكن أن توقف أو تبطّئ تقدّمه، وذلك في دراسة نُشرت في مجلة Science.
لقد قامت جامعة UNSW والفريق البحثي التابع لمركز البحث في علم الأعصاب في استراليا بتحديد البروتين كيناز بي38واي kinase p38y الذي يُفقد أثناء تقدّم داء آلزهايمر، حيث قاموا بإعادة إدخال هذا البروتين في أدمغة فئران مصابة بالمرض مما أدى إلى تأثير وقائي ضد مشاكل الذاكرة المترافقة مع المرض.
يقول البروفيسور لارس إتنر Lars Ittner وهو المؤلف الرئيسي للدراسة في جامعة UNSW: "لقد غيّرت هذه الدراسة بشكل كامل من فهمنا لما يحدث أثناء تطور داء آلزهايمر".
هناك سمتان أساسيتان مميزتان لداء آلزهايمر في الدماغ وهما لويحات بروتينية من الأميلويد بيتا، وتشابكات من البروتين تاو، ويرتبط تراكم هذه اللويحات والتشابكات بالموت الخلوي وضمور الدماغ وفقدان الذاكرة.
وكشف الفريق البحثي أن خطوة رئيسية في العملية التي تؤدي إلى هذه التشابكات قد فُهمت بشكل خاطئ، فقد اعتقد العلماء سابقاً بأن البروتين المشكل للويحات (وهو الأميلويد بيتا) يتسبب بتعديل (يُدعى الفسفرة) للبروتين تاو، وأن هذا التعديل يؤدي إلى الموت الخلوي وفي النهاية إلى داء آلزهايمر، وتؤدي زيادة الفسفرة للبروتين تاو إلى تراكمه كتشابكات.
بينما كشفت نتائج الدراسة الحديثة أن فسفرة البروتين تاو لها دور وقائي للعصبونات، لكن الأميلويد بيتا يهاجم هذه الوظيفة الوقائية حتى تُفقد تدريجياً، وفي هذه المرحلة تتسبّب المستويات السميّة بتخريب للعصبونات مؤدية إلى عيوب الإدراك التي ترافق داء آلزهايمر.
يقول البروفيسور إتنر: "يُحدث الأميلويد بيتا تأثيراً سمّياً على العصبونات بينما تهدف الخطوة الأولى من فسفرة البروتين تاو إلى تقليل هذه السميّة. إنها فكرة جديدة كليّاً أن يكون السبب بتعديل البروتين تاو هو الحماية من الضرر".
وقد استخدمت الدراسة نماذج مختلفة من الفئران ومن النسيج الدماغي البشري من بنك الدماغ في سيدني لتحديد بروتين يُدعى البروتين كيناز p38y الذي يُساهم في الفسفرة الوقائية للبروتين تاو ويتعارض مع السمية المُحدَثة بالأميلويد بيتا.
يقول البروفيسور إتنر: "لقد استخدمنا الفئران للكشف عن سمية نوعية جداً كُشِفَ في دراسة سابقة أنها تتدخل في تطور المرض. وبدأنا بحثنا لإيجاد الوسطاء في هذا التطور مما قادنا نحو نتيجتنا المُفاجِئة المعاكسة لما توقعناه، ولم يكن لهذه النتائج معنى منطقي إلى أن غيّرنا نظرتنا للعملية المتدخلة في تطور المرض".
وكشف البروفيسور إتنر وفريقه بدراسة نسيج الدماغ البشري أنه خلال تقدم المرض يُفقد البروتين كيناز p38y ولكن يبقى منه كمية صغيرة في الدماغ.
ويقول أيضاً: "لقد كشفنا أن p38y الذي يقدّم الحماية في البداية، يتناقص باكراً في أدمغة المصابين بداء آلزهايمر مما ينتج عنه خسارة هذه الحماية. لقد اعتمد جزء من دراستنا على إعادة هذا البروتين وزيادة نشاطه، ووجدنا أنه يمنع حدوث عيوب الذاكرة عند الفئران، مما يعني أن له إمكانية علاجية حقيقية. إذا تمكنّا من تنبيه هذا النشاط من الممكن أن نستطيع تأخير أو حتّى إيقاف تقدم داء آلزهايمر".
ستكون الخطوة القادمة للباحثين تطوير اكتشافاتهم المسجّلة إلى علاجٍ جديد للبشر خاضع لتمويل جديد.