في عالمنا الذي تزداد حرارته باستمرار، أصبح إيجاد طريقة للتخلّص من غازات الدفيئة الموجودة في الجو وتلبية احتياجات الطاقة المفتاحَ لنجاتنا واستمرارنا على الأرض في القرون القادمة، ويأتي بحث جديد ليقرِّبنا خطوة من هذ هذه الغاية عن طريق تطوير بطارية قابلة لإعادة الشحن تعمل على محلول من ثنائي أوكسيد الكربون والهواء.
في الماضي، استخدم الباحثون انبعاثات غازات الدفيئة لإنتاج مصدر للطاقة عن طريق تحويل ثنائي أوكسيد الكربون مباشرة إلى وقود مثل الإيثانول، مع عدم الحاجة للنباتات للقيام بهذا العمل، وكان فريق في مختبر لورنس ليفرمور المّحلي العام الماضي قد قدّم مقترحًا مختلفًا ينصُّ على ضخّ الغازات المنبعثة في اّبار عُمقها 1 أو 2 كيلومتر تحت الأرض، لدفع المياه الساخنة نحو سطح الأرض للاستفادة من الطاقة الحرارية الأرضية.
ولكن، ماذا لو تمكنّا من استخدام ثنائي أوكسيد الكربون في إنتاج البطاريات مباشرة؟ درس الباحثون إمكانية ذلك في الماضي، ولكن معظم الخطط لإنتاج الكهرباء من ثنائي أوكسيد الكربون الموجود في الجو تكلفتها كبيرة ولا تنتج تيّارًا قويًّا.
ويعتقد فريق من جامعة بنسلفانيا أنّ اختراعهم الجديد ينهي ذلك التوجه، إذ يقول عضو الفريق كريستوفر غورسكي Christopher Gorski في حديثه مع ليزا زايغا Lisa Zyga من موقع phys.org: "يوفّر هذا العمل طرقًا بديلة وبسيطة لاستخلاص الطاقة من انبعاثات ثنائي أوكسيد الكربون بالمقارنة مع التكنولوجيا الحالية التي تحتاج وسيطًا محفزًا للتفاعل غالي الثمن ودرجات حرارة عالية لتحويل ثنائي أوكسيد الكربون إلى وقود".
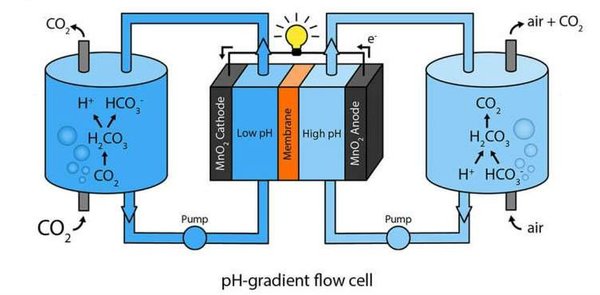
يعتمد تركيب هذه التقنية على مبدأ بسيط، يستند على نوع من البطاريات تسمى خلية التدفق flow cell.
تخيل وعائين مفصولين عن بعضهما بواسطة غشاء نصف نَفُوذ (نصف مَسامي). وبتطبيق عملية تدعى النضح sparging يُحَلُّ غاز من الهواء المحيط في الماء ويُضاف لأحد الوعائين.
في الوعاء الثنائي، يوجد كمية من خليط الماء وثنائي أوكسيد الكربون النقي المذاب فيه مشابهة للكمية في الوعاء الأول. عند إذابة ثنائي أوكسيد الكربون ينفصل إلى أيونات الهيدروجين الموجبة -أو بروتونات عادية- وإلى بيكربونات، مما يجعل الرقم الهيدروجيني للمحلول مساويًا 7.7=ph.
ولأنَّ المحلول في الوعاء الثنائي (الذي تدفّق فيه الهواء) ذو رقم هيدروجيني 9.4 أعلى من المحلول في الوعاء الأول، يشكّل الخليط مدروجًا من الجزيئات المُذابة بتراكيز مختلفة.
لا يمكن لمعظم الجزيئات المرورُ عبر الحاجز، ولكن الأيونات تمر بحريّة من محلول إلى اّخر. نتيجة لذلك، يحدث فرق جهد بين قُطبي أوكسيد المنغنيز في كلا الوعائين، والذي بدوره يؤدي إلى إنتاج تيارٍ كهربائي.
عندما تستنفد الخلية، يمكن إعادة شحنها بسهولة عن طريق تبديل المحاليل بين طرفي القطبين الكهربائيين، ووجد الباحثون أن بإمكانهم تبديل المحاليل ذهابًا وإيابًا أكثر من 50 مرة مع الحفاظ على نفس درجة الكفاءة للبطارية. تبلغ كثافة الطاقة التي تنتجها الخلية ما معدله 0.82 واط/م وهي قيمة² أعلى ب 200 مرة تقريبًا من التجارب السابقة. كما أنّ المواد المستخدمة رخيصة الثمن بالمقارنة مع التجارب السابقة.
على الرغم من إمكانيتنا الحصول على نتائج أفضل باستخدام محاليل أخرى، إلا أنها تبشِّر بنتائج جيدة يعتقد الباحثون أنّها ستنتج مستقبلًا إنتاجًا كبيرًا يكفي لجعلها تستحق تكاليف تصنيعها.
ومن المُعيقات أيضًا لهذه التقنية، والتي ينبغي التغلُّب عليها هي جعلها تعمل مع خليط الغازات الذي ينتجه حرق الوقود الأحفوري، فما زالت المحاليل تعتمد حتى الاّن على ثنائي أوكسيد الكربون النقي والهواء النظيف نسبيًا. ولكن مع خفض التكلفة وتحسين إنتاج الطاقة، يمكن لتقنية كهذه أن تعطينا الخطوات البدائية اللازمة لمعالجة تغير المناخ مع تلبية حاجتنا المستمرة للطاقة.
نُشِر هذا البحث في مجلة Environmental Science & Technology Letters.