تخيل عالمًا لا بد فيه أن نوصل كل ما يشتغل بالاعتماد على الكهرباء بالمقبس!
ابتداءً من المصباح اليدوي، وآلة الإنصات لضعاف السمع، ووصولًا إلى الهواتف الخلوية وغيرها من الأجهزة المحمولة. لا بد أن يجعلها ذلك غير مريحة وغير عملية. لن يكون من الممكن تشغيل السيارات بلفة مفتاح بسيطة، بل سيتطلب الأمر ضغطًا قويًا لتحريك المكابس. ستعلق الكابلات في كل مكان، مشكلةً خطرًا على السلامة وفوضى بشعة. لحسن الحظ تزوّدنا البطاريات بمصدر طاقة متحرك يجعل الكثير من وسائل الراحة الحديثة ممكنة.
بالرغم من وجود العديد من أنواع البطاريات المختلفة، إلّا أن المبدأ الأساسي لعملها يبقى نفسه. عند ربط جهاز ما ببطارية، يحدث تفاعل منتجًا طاقةً كهربائية. وهو ما يُعرف بالتفاعل الكهروكيميائي. أول من اكتشف هذه العملية هو الفيزيائي الإيطالي الكونت أليساندرو فولتا Count Alessandro Volta في 1799 عند ابتكاره بطارية بسيطة من الصفائح المعدنية، والكرتون أو الورق المنقوع بمحلول ملحي. ومن وقتها، طور العلماء من تصميم فولتا الأصلي ليصنعوا بطاريات مصنوعة من عدة مواد وبأحجام مختلفة.
اليوم، تتواجد البطاريات حولنا في كل مكان، تشغّل ساعات أيدينا لشهور لدى تغييرها مرةً واحدة، وتبقي ساعات المنبه والهواتف قيد العمل حتى إن انقطعت الكهرباء. تشغل كاشفات الدخان، وماكينات الحلاقة الكهربائية، والمثقاب الكهربائي، ومشغلات mp3، والترموستات، وقائمة طويلة من الآلات. وإن كنت تقرأ هذا المقال على حاسوبك المحمول أو هاتفك الذكي، فمن الممكن أنك تستخدم البطاريات الآن. لعل انتشار مخازن الطاقة المتحركة هذه وشيوع استخدامها يجعلها عرضةً للاستخفاف، لذا ستمنحك هذه المقالة تقديرًا أكبر للبطاريات من خلال استكشاف تاريخها، وكذلك الأجزاء الأساسية والتفاعلات والعمليات التي تجعلها تعمل. إذن اصرف عنك هذه الأحكام المسبقة واقطع عنها الإمداد، وانطلق عبر دليلنا الغني بالمعلومات لشحن معرفتك بالبطاريات.
تاريخ البطاريات
كانت البطاريات موجودة لفترة أطول مما تظنون، ففي عام 1938، اكتشف عالم الآثار ويلهلم كونيغ Wilhelm Konig بعض الأواني الفخارية الغريبة بينما كان يحفر في خوجوت رابه Khujut Rabu خارج بغداد الحالية في العراق. احتوت الجرار التي كانت بطول 5 بوصات (12.7 سم)، والتي يعود تاريخها إلى نحو 200 سنة قبل الميلاد، على قضيب حديدي مغطى بالنحاس. كشفت الاختبارات أن تلك الأوعية احتوت على مادة حمضية كالخل أو النبيذ، ما قاد كونيغ للاعتقاد أنها كانت بطاريات قديمة. منذ هذا الاكتشاف صنع العلماء نسخ من الآنية قادرة بالفعل على توليد شحنة كهربائية. ربما تكون "بطاريات بغداد" هذه قد استخدمت للطقوس الدينية، والأغراض الطبية، أو حتى الطلاء بالكهرباء Electroplating.
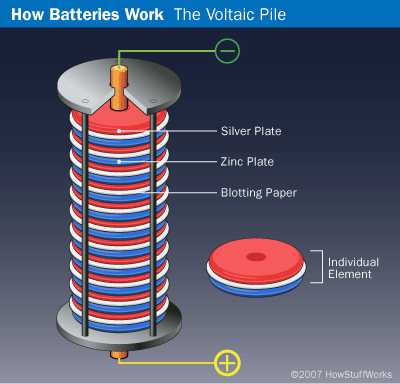
في 1799 صنع الفيزيائي الإيطالي الكونت أليساندرو فولتا البطارية الأولى عبر تكديس طبقات متتالية من الزنك، والكرتون أو القماش المنقوع في محلول ملحي، والفضة. هذه التراتبية التي كانت تُدعى بالكومة الفولتية Voltaic pile، لم تكن أول جهاز يولد الكهرباء، ولكنها كانت الأولى التي تولد تيارًا ثابتًا ودائمًا. كانت هناك بعض العيوب في اختراع فولتا، فالارتفاع الذي يمكن أن تتكدس به الطبقات كان محدودًا لأن وزن الكومة سيؤدي لعصر المحلول الملحي وخروجه من الكرتون أو القماش، كما تميل الأقراص المعدنية أيضًا إلى الصدأ بسرعة مما يقصّر عمر البطارية. على الرغم من هذه العيوب تُسمى الوحدة الدولية الأساسية للقوة الدافعة الكهربائية SI unit الآن بالفولت تكريمًا لإنجاز فولتا.
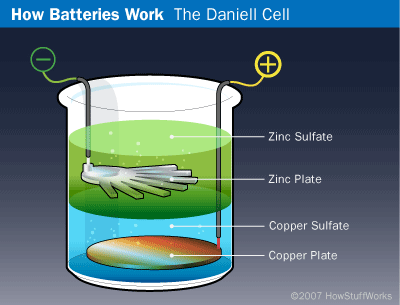
حدث الازدهار التالي في تكنولوجيا البطاريات في عام 1836 عندما اخترع الكيميائي الإنكليزي جون فردريك دانييل John Frederick Daniell خلية دانييل Daniell cell. في هذه البطارية الأولية (البدائية)، توضع صفيحة نحاسية في الجزء السفلي من وعاء زجاجي ويُسكب فوق الصفيحة محلول كبريتات النحاس حتى يملأ نصف الوعاء. ثم تُعلّق صفيحة زنك في الوعاء، ويضاف إليها محلول كبريتات الزنك. ونظرًا لأن كبريتات النحاس أكثر كثافة من كبريتات الزنك، فإن محلول الزنك يطفو أعلى محلول النحاس ليحيط بصفيحة الزنك. يمثل السلك المتصل بهذه الأخيرة الطرف السالب، بينما يمثل السلك القادم من الصفيحة النحاسية الطرف الموجب. من الواضح أن هذه الترتيبة لم تكن لتعمل بشكل جيد في مصباح الجيب، ولكن بالنسبة للتطبيقات الثابتة كان عملها على ما يرام. حقيقةً كانت خلية دانييل طريقةً شائعةً لتزويد أجراس الأبواب والهواتف بالطاقة قبل أن تولَّد الكهرباء.
بحلول عام 1898، أصبحت الخلية الجافة لكولومبيا Columbia Dry Cell أول بطارية متوفرة تجاريًا تُباع في الولايات المتحدة. غيّر المصنّع اسمه لاحقا من الشركة الوطنية للكربون National Carbon Company إلى شركة إفريدي باتري Eveready Battery، التي تُنتج علامة إنرجايزر Energizer.
والآن بعد أن أصبحت تعرف بعضًا من تاريخها، أكمل القراءة للتعرف على الأجزاء المختلفة من البطارية.
تشريح البطارية
ألقِ نظرةً على أي بطارية، وستلاحظ أن لديها نهايتين (قطبين) اثنين. على أحدهما علامة (+) أو موجب، وعلى الآخر علامة (-) أو سالب. في بطاريات مصباح الجيب العادية، مثل خلية AA، أو C، أو D تتموضع الأقطاب على النهايات. ولكن في بطارية 9 فولت أو بطارية السيارة تقع الأقطاب بجانب بعضها البعض في الجزء العلوي من الوحدة. إذا قمت بوصل سلك بين القطبين سوف تتدفق الإلكترونات من النهاية السالبة إلى النهاية الموجبة بأسرع ما يمكنها. سيؤدي ذلك إلى إتلاف البطارية بسرعة ويمكن أن يشكل ذلك خطرًا أيضًا، خاصةً في البطاريات الأكبر حجمًا. لتوليد شحنة كهربائية من البطارية بشكلٍ صحيح، يجب أن تصلها بحمل Load. قد يكون الحمل شيئًا كمصباح كهربائي أو محرك أو دارة إلكترونية مثل المذياع.
تُغطّى المكونات الداخلية للبطارية عادةً ضمن غطاء معدني أو بلاستيكي. داخل هذا الغطاء يوجد المهبط Cathode الذي يتصل بالطرف الموجب، والمصعد Anode الذي يتصل بالطرف السالب. هذه المكونات التي تُعرف بشكل عام بالإلكترودات Electrodes ، تشغل معظم مساحة البطارية وهي المكان التي تحدث فيها التفاعلات الكيميائية. يشكّل عازل separator فاصلًا بين المهبط والمصعد، مما يمنع الإلكترودات من التلامس مع السماح للشحنة الكهربائية بالتدفق بحريةٍ فيما بينها. يُعرف الوسيط الذي يسمح بتدفق الشحنة الكهربائية بين المهبط والمصعد باسم إلكترولايت Electrolyte. وأخيرًا، يقود المجمّع Collector الشحنات إلى خارج البطارية عبر الحمل.
تاليًا، سوف نستكشف كيف يعمل المهبط والمصعد والإلكترولايت والفاصل والمجمّع معًا لإنتاج تيار كهربائي والحفاظ على استمرارية الأجهزة المحمولة.
تفاعلات البطارية وكيمياؤها
يحدث الكثير ضمن البطارية عندما تضعها في مصباح الجيب أو جهاز التحكم عن بعد أو الأجهزة الأخرى اللاسلكية. في حين تختلف العمليات التي تنتج الكهرباء قليلًا من بطارية إلى أخرى، إلّا أن الفكرة الأساسية لا تزال نفسها.
عندما يكمل الحمل الدورة بين القطبين، تُنتج البطارية الكهرباء من خلال سلسلة من التفاعلات الكهرومغناطيسية بين المصعد والمهبط والإلكترولايت. يحدث تفاعل أكسدة Oxidation reaction في المصعد بحيث يجتمع اثنان أو أكثر من الأيونات (ذرات أو جزيئات مشحونة كهربائياً) من الإلكترولايت مع المصعد لتنتج مركبًا وتحرر واحدًا أو أكثر من الإلكترونات. في الوقت نفسه، يمر المهبط بتفاعلات إرجاع أو اختزال Reduction reaction حيث تجتمع أيضًا مادة المهبط والأيونات والإلكترونات الحرة لتشكل مركبات. على الرغم من أن هذا الحدث يبدو معقدًا غير أنه في الحقيقة بسيط جدًا. يقوم التفاعل في المصعد بخلق إلكترونات يمتصها التفاعل في المهبط. والمنتج الخالص هو الكهرباء. ستستمر البطارية في إنتاج الكهرباء إلى أن تنفد لدى أحد الإلكترودين أو كليهما المادةُ اللازمة لحدوث التفاعلات.
تستخدم البطاريات الحديثة مجموعة متنوعة من المواد الكيميائية لإذكاء تفاعلاتها. تحتوي كيمياء البطارية الشائعة على ما يلي:
- بطارية الزنك والكربون: كيمياء الزنك والكربون شائعة في كثير من البطاريات الخلوية الجافة الرخيصة من نوع AAA وAA وC وD. المصعد زنك، والمهبط ثاني أوكسيد المنغنيز، والإلكترولايت هو كلوريد الأمونيوم أو كلوريد الزنك.
- البطارية القلوية: هذه الكيمياء شائعة أيضًا في بطاريات الخلايا الجافة من نوع AA وC وD. ويتكون المهبط من خليط ثاني أوكسيد المنغنيز، بينما يتكون المصعد من مسحوق الزنك. حصلت هذه البطاريات على اسمها من إلكترولايت هيدروكسيد البوتاسيوم، وهو مادة قلوية.
- بطارية ليثيوم-أيون (قابلة للشحن): تُستخدم كيمياء الليثيوم غالبًا في الأجهزة عالية الأداء، من مثل الهواتف المحمولة والكاميرات الرقمية وحتى السيارات الكهربائية. تُستخدَم مجموعة متنوعة من المواد في بطاريات الليثيوم، ولكن هناك مزيج شائع هو مهبط من أوكسيد كوبالت الليثيوم ومصعد من الكربون.
- بطارية الرصاص الحمضية (القابلة للشحن): وهذه هي الكيمياء المستخدمة في بطارية السيارة الاعتيادية. تُصنع الإلكترودات عادةً من ثاني أوكسيد الرصاص والرصاص المعدني، بينما يكون الإلكترولايت من محلول كبريتي حمضي.
أفضل طريقة لفهم هذه التفاعلات هي رؤيتها بنفسك. أكمل لرؤية بعض التجارب العملية على البطارية.
تعمل على الهواء؟
يطوّر الباحثون حاليًا بطاريةً حيث تكون الإلكترودات من الليثيوم، وبشكلٍ مثير للدهشة، من الأوكسجين في الهواء أيضًا. قد يخفض تقدم كهذا وزن البطارية بشكلٍ كبير ويزيد الطاقة التي تنتجها بطاريات الليثيوم-أيون التقليدية من 5 إلى 10 أضعاف. على الرغم من أنه ما يزال لدى هذه التكنولوجيا العديد من العوائق لتخطيها، إلّا أنها في يومٍ ما يمكن أن تحدث ثورةً في صناعة السيارات الكهربائية.
تجارب على البطارية: الكومة الفولتية
إن كنت تريد أن تعرف أكثر عن التفاعلات الكهروكيميائية التي تحدث في البطاريات، فبإمكانك صنع واحدة بنفسك باستخدام مواد منزلية بسيطة. عليك شراء شيء واحد قبل البدء وهو مقياس فولت-أوم رخيص بقيمة (10 إلى 20 دولار) من محل إلكترونيات أو معدات كهربائية محلي. تأكد إن كان بإمكان المقياس قياس الجهد الكهربائي المنخفض (في نطاق واحد فولت) والتيارات المنخفضة (في نطاق 5 إلى 10 ميلي أمبير). بامتلاكك هذه الأداة ستتمكن من تحديد جودة عمل بطاريتك.
بإمكانك صنع بطاريتك الفولتية بنفسك باستخدام الأرباع (العملة المعدنية)، وورق القصدير، وورق التنشيف، وخل التفاح، والملح. قص ورق القصدير وورق التنشيف إلى دوائر، ثم انقع ورق التنشيف في خليط من خل التفاح والملح. باستخدام شريط لاصق، صل سلكًا نحاسيًا إلى أحد أقراص القصدير. الآن جمّع المواد بهذا الترتيب: قصدير، ورقة، قطعة نقدية، قصدير، ورقة، قطعة نقدية، وهكذا حتى تكرر هذا النمط 10 مرات. حالما تضع آخر عملة على الكومة، صلها بسلك مستخدمًا شريطًا لاصقًا. وأخيرًا صِل نهايتي السلكين الحرتين إلى مصباح LED، من المفروض أن يضيء هذا المصباح. يمثل النحاس الموجود في القطعة النقدية في هذه التجربة المهبط، ويمثل القصدير المصعد، ويمثل محلول خل التفاح والملح الإلكترولايت، ويلعب ورق التنشيف دور الفاصل الفاصل.
كما يمكن صنع بطارية منزلية باستخدام سلك نحاسي، ومشبك أوراق، وحبة ليمون. أولًا قم بقص جزء قصير من سلك نحاسي واجعل المشبك مستقيمًا. استعمل ورق صنفرة لتمليس أي أجزاء خشنة على نهايات قطعتي المعدن. اعصر قلب الليمونة برفق عن طريق دحرجتها على طاولة، لكن احذر تمزيق القشرة. أدخل الشريط النحاسي ومشبك الورق إلى داخل الليمونة، تأكد من تقريبهما من بعضهما قدر الإمكان دون أن يتلامسا. وأخيرًا اربط مقياس فولت-أوم بنهايات السلك النحاسي والمشبك، وألقِ نظرةً على الجهد الكهربائي والتيار اللذَين تنتجهما بطاريتك.
الآن، لا بد أن تكون قد تعرفت على المبادئ الأساسية التي تستخدمها البطاريات لإنتاج الكهرباء. تابع القراءة لاكتشاف كيف يمكن إعادة شحن بعض البطاريات.
الوقود ضد الكهرباء
يبقى الغازولين على الرغم من عيوبه وقود السيارات الأكثر انتشارًا. لماذا لم تستطع البطاريات مجاراة الغازولين (البنزين) إذًا؟ واحدة من أكبر المشاكل هي كثافة الطاقة، أي مقدار الطاقة التي يمكن أن يخزنها الوقود نسبةً إلى وزنه، والتي تقاس بالواط الساعي للكيلوغرام. فكثافة طاقة البنزين تساوي نحو 13,000 واط ساعي لكل كيلوغرام، بينما لا تتعدى أفضل بطارية ليثيوم-أيون متوفرة حاليًا أكثر من 200 واط ساعي للكيلوغرام. [المصدر: Manjoo].
البطاريات القابلة للشحن
مع انتشار الأجهزة المحمولة مثل الكمبيوتر المحمول والهاتف النقال ومشغل ال إم بي ثري والأدوات الكهربائية اللاسلكية، ازدادت الحاجة إلى البطاريات القابلة للشحن بشكل ملموس في السنوات الأخيرة. وقد كانت البطاريات القابلة للشحن متواجدة منذ 1859، عندما اخترع الفيزيائي الفرنسي غاستون بلانت Gaston Plante بطارية الرصاص الحمضية. بمصعد من الرصاص، ومهبط من ثاني أوكسيد الرصاص، وإلكترولايت من حمض الكبريت، كانت بطارية بلانت بادرة لبطاريات السيارات الحديثة.
تولد البطاريات غير القابلة للشحن -أو الخلايا الأولية primary cells- والبطاريات القابلة للشحن -أو الخلايا الثانوية secondary cells - التيار بنفس الطريقة تقريبًا: من خلال تفاعل كهروكيميائي يتضمن مصعدًا ومهبطًا وإلكترولايت. لكن يكون التفاعل معكوسًا في البطاريات القابلة للشحن. فعندما تُطبَّق طاقة كهربائية من مصدر خارجي على خلية ثانوية، يُعكس تدفق الإلكترونات السالب إلى الموجب الذي يحدث أثناء التفريغ، وتُستعاد شحنة الخلية. أكثر البطاريات القابلة للشحن شيوعًا والمتوافرة حاليًا في السوق هي بطاريات الليثيوم-أيون lithium-ion (LiOn)، كما أن بطاريات النيكل-ميتال هايدريد nickel-metal hydride (NiMH) والنيكل-كادميوم nickel-cadmium (NiCd) كانت سابقًا واسعة الانتشار.
عندما يتعلق الأمر بالبطاريات القابلة للشحن، نجد أن البطاريات لم تُصنع كلها متساوية. كانت بطاريات NiCd ضمن أولى الخلايا الثانوية الأكثر انتشارًا، لكنها عانت من مشكلةٍ غير ملائمة عرفت بتأثير الذاكرة memory effect. أي مبدئيًا إن لم تفرغ هذه البطاريات بشكلٍ كامل في كل مرة تُستخدَم فيها، ستفقد استطاعتها بسرعة. استُبعِدت بطاريات NiCd بشكلٍ تدريجي وواسع لصالح بطاريات NiMH. تمتاز هذه الخلايا الثانوية باستطاعة أكبر وبتأثر أقل بتأثير الذاكرة، لكن العمر التخزيني لديها ليس جيدًا جدًا. ولدى بطاريات LiOn صلاحية طويلة كبطاريات NiMH، لكنها تحتفظ بالشحن بشكلٍ أفضل، وتعمل في جهد كهربائي أعلى، وتأتي بحجم أصغر ووزن أخف. أساسًا، تستفيد كل الأجهزة التكنولوجية عالية الجودة المصنعة في أيامنا هذه من هذه التكنولوجيا. لكن بطاريات LiOn لا تتوفر حاليًا بالقياس الاعتيادي كبطاريات AAA، وAA، وC، وD، وهي أكثر غلاءً بكثير من نظيراتها الأقدم.
قد يكون الشحن صعبًا مع بطاريات NiCd وبطاريات NiMH. يجب أن تكون حذرًا بألّا تشحنها بإفراط، لأن هذا قد يؤدي إلى انخفاض استطاعتها. لمنع هذا من الحدوث، تبدّل بعض الشواحن وضعها إلى الشحن الخفيف أو توقف الشحن ببساطة عند اكتمال الشحن. يجب أيضًا تجديد بطاريات NiMH وبطاريات NiCd ، أي تفريغها بالكامل وشحنها مجددًا من فترةٍ لأخرى لتقليل أي خسارة في استطاعتها. وهذا ما لا نجده لدى بطاريات LiOn التي تمتلك شواحن متطورة تمنع الإفراط بالشحن ما يجعلها في غنىً عن التجديد recondition.
حتى البطاريات القابلة للشحن سوف تفرغ في نهاية المطاف، على الرغم من أن ذلك قد يستغرق مئات المرات من الشحن قبل الحدوث. عندما تفرغ أخيرًا تأكد من التخلص منها في منشأة إعادة تدوير.
وبعد ذلك، دعونا نلقي نظرةً على ترتيب البطارية.
ترتيب البطارية وطاقتها
في العديد من الأجهزة التي تستخدم البطاريات - كأجهزة الراديو المحمولة ومصابيح الجيب - فإنك لا تستخدم خليةً واحدة فقط في كلّ مرة، بل تجمعها عادةً معًا في ترتيبٍ متسلسلٍ لزيادة الجهد الكهربائي أو في ترتيب متوازي لزيادة التيار. كما هو موضح في الرسم البياني.

يبين المخطط السفلي ترتيبًا تسلسليًا. ستولد البطاريات الأربع في السلاسل معًا التيار لخليةٍ واحدة، لكن الجهد الذي تولده سيكون أربعة أضعاف الجهد الذي تولده خلية واحدة. الجهد Voltage هو كمية شحنة الطاقة بالوحدة، ويُقاس بالفولت. ويحدد الجهد في البطارية مدى قوة دفع الإلكترونات عبر الدارة، مثلما يحدد الضغط مدى قوة دفع الماء عبر خرطوم. معظم بطاريات AAA، وAA، وC، وD هي بجهد 1.5 فولت تقريبًا.
تخيل أن البطاريات الموضحة في الرسم البياني أعلاه بجهد 1.5 فولت وتيار 500 مللي أمبير في الساعة. ستولد البطاريات الأربع في الترتيب المتوازي 1.5 فولت عند 2000 ميلي أمبير ساعي. وستولد البطاريات الأربع المرتبة في سلاسل 6 فولت عند 500 ميلي أمبير ساعي.
تطورت تكنولوجيا البطاريات بشكلٍ هائل منذ أيام الكومة الفولتية، وتظهر هذه التطورات بوضوح في عالمنا السريع المتحرك، الأكثر اعتمادًا من أيّ وقتٍ مضى على مصادر الطاقة المحمولة التي توفرها البطاريات. يمكن للمرء أن يتخيل فقط ما سيجلبه الجيل التالي من البطاريات الأصغر والأقوى والأطول أمدًا.


