ما الذي لا تملكه هذه البطارية؟ فهي مرنة وسريعة وغير سامة ولا تحترق وموادها غير مُكلفة،كما أنها تستطيع حمل نفس الشحنة حتى بعد إعادة شحنها 7500 مرة، بالمقارنة ببطاريات الليثيوم أيون والتي يمكن إعادة شحنها بين 1000 و 3000 مرة. كما يمكن الاعتماد عليها في إيصال ما بين 2 و 2.5 فولت. وعلى الرغم من أنها تعاني من بعض القيود، إلا أن قائمة المنافع التي قد تقدمها هذه التقنية تطول وتطول.
شيء من التاريخ
قبل العام 1800، كانت الكهرباء تُنتَج بواسطة "الاحتكاك" (friction)، أي فرك العنبر (الكهرمان) بقطعة قماش ما يؤدي إلى نقل الإلكترونات من القماش إلى العنبر، وبالتالي شحن العنبر بشحنة سالبة والقماش بشحنة موجبة. أما فرك الزجاج بقطعة قماش فسيشحن الزجاج بشحنة موجبة والقماش بشحنة سالبة. وقد اعتمَد بنيامين فرانكلين (Benjamin Franklin) مصطلحيْ الموجب والسالب في القرن الثامن عشر.
في ثمانينيات القرن الثامن عشر، كان لويجي جالفاني (Luigi Galvani)- وهو أستاذ في إيطاليا- يُجري تجارباً على انقباض العضلات باستخدام الكهرباء. ووجد أن عضلات ساق الضفدع تنقبض حين يلامسها جسم مشحون كهربائياً. كما وجد أن العضلات تنقبض، أيضاً، إذا تم وضع معدنيْن مختلفيْن في العضلة (دون استخدام شحنات). وقد اعتقد كثيرٌ من الناس، في ذلك الوقت، أن هذه كانت "قوة حيوية" (life-force).
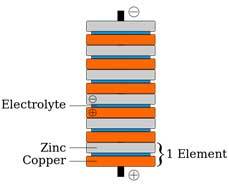
أما فولتا (Volta)، وهو أستاذ لدى جامعة مجاورة، فقد ارتاب في الأمر، وقرر اختبار كيفية تفاعل المعادن المختلفة مع عضلة الضفدع، وخلُص إلى استنتاجٍ مفاده أن عضلة الضفدع هي جهاز أفضل بكثير من جهاز القياس المستخدم، في ذلك الوقت، لقياس ما نسميه اليوم "الفولتية أو الجهد" (voltage) -مقياس الطاقة الكامنة لكل شحنة-. كما أنه شكّ أيضاً في احتمال أن تكون رطوبة ساق الضفدع هي ما سمح بتدفق الشحنة بين المعدنيْن المختلفيْن، وقد كان على صواب. ثم اختبر فولتا كثيراً من المعادن وأنواعاً من السوائل، ووجد أن بعضها يُنتج تأثيرات أكبر من البعض الآخر. فقرر رصَّ أقراصٍ من المعادن المختلفة بقطعة قماش مبللة بمحلول ملحي، أو قطعة قماش مبللة بمحلول حمضي مخفف، ووجد أن المحلوليْن أنتجا التأثير الأكبر. إذ يتطاير الشرر عند توصيل شريط سلكي رقيق بكوْمتين عن قرب. ما صنعه فولتا كان البطارية الأولى، وهي تُعرف الآن باسم "بطارية الكومة" (pile battery).
يدخل الزنك أيون (\(Zn2+\)) إلى محلول الاستقطاب (electrolyte) -محلول المياه المالحة-، وهي العملية التي تُسمى الأكسدة، لأن الزنك يُخلّف الإلكترونات وراءه، وسيشكل أكسيد الزنك (ZnO) مع ذرات الأكسجين في المحلول، فيصبح قرص الزنك سالب الشحنة. ثم يكتسب اثنان من أيونات الهيدروجين (\(H+\)) من الماء الإلكترونات من النحاس، لتشكيل غاز \(H2\)، الذي يتحول إلى فقاعات (يسمى هذا "الاختزال" (reduction)، بسبب اكتساب الإلكترونات). فتُترك الأقراص النحاسية بشحنة موجبة. وتتدفق الإلكترونات من أقراص الزنك إلى الأقراص النحاسية.

الفيزياء الأساسية للبطارية
الفيزياء الأساسية الكامنة وراء البطارية بسيطة. الشحنات المتماثلة تتنافر، والشحنات المختلفة تتجاذب. إذا تمكَّن المرء من وضع حفنة من الشحنات المتشابهة في موضع واحد، فإنها ستتنافر عن بعضها البعض وتنتشر، إذا أتيحت لها الفرصة. ولقد تبين أنه من الأسهل التعامل مع الأبعد من إلكترونات المعادن. فهي تتدفق بشكل جيد للغاية من إحدى ذرات المعدن إلى الأخرى، ومن ثم تنتشر عبر السطح الخارجي للجسم المعدني للابتعاد قدر الإمكان عن بعضها البعض. وإذا كان الجسم المعدني المشحون موصولاً بجسم آخر مشحون بشحنة سالبة أقل، أو بشحنة محايدة أو بشحنة موجبة تسمح بتدفق الإلكترونات، فإن الإلكترونات من جسم معدني سالب الشحنة ستُدفع بواسطة قوة التنافر بينها إلى منطقة محايدة أو أقل سلباً، مع جذب (pull) إضافي إذا كانت هناك شحنات موجبة على الجسم الآخر. ويُعّرف الأنود (القطب الموجب) بأنه مصدر الإلكترونات، والكاثود (القطب السالب) بأنه الجانب الذي تتدفق الإلكترونات إليه عند تفريغ البطارية. كما يُعّرف التيار (كمية الشحنة في وقت التدفق عبر السطح) بأنه يتدفق في الاتجاه المعاكس لاتجاه الإلكترونات، لأسباب تاريخية.
على امتداد الطريق، تستطيع هذه الشحنات الحاملة للطاقة أن تتخلى عن شيء من طاقتها لجهاز من مثل المصباح الكهربائي، أو لفائف الاحترار في محمصة، أو لجهاز كمبيوتر محمول.
إن صُنع الأقطاب الموجبة والسالبة، هو بالضبط ما فعله فولتا، وبدلاً من المحلول السائل، في الخلية الجافة (dry cell) العادية أو البطاريات القلوية (alkaline batteries)، يُوضع بين المعادن المختلفة معجون رطب بما يكفي للسماح للأيونات بالدخول إلى محلولٍ لصنُع الأنود والكاثود. وتُوصلُ الأقطاب الخارجية للبطارية بمعادن مختلفة داخلها.
هناك ثلاثة عناصر مهمة، هي:
1) المحلول الذي يسمح بتشكيل الأيونات ونقلها، لصنع القطبيْن الموجب والسالب.
2) المادة الموصلة، التي ستتفاعل مع المحلول، لكي تدخل بعض ذراتها كأيونات في المحلول، مخلفة الإلكترونات وراءها.
3) المادة الأخرى، التي ستتفاعل مع المحلول أو الأيونات الموجبة، لكي تصبح موجبة الشحنة، أو تبقى محايدة، أو لكي لا تصبح سالبة الشحنة بنفس قدر المادة الأولى. ويجب أن تسمح، أيضاً، بتدفق الإلكترونات عبرها.
تُشّغِلُ التفاعلات الكيميائية البطارية، كما تؤدي أيضا إلى اضمحلالها مع مرور الوقت، نتيجة ترسب المواد على المعادن المختلفة، أو تفكك المحلول بسبب تفاعلات غير مرتبطة بتشكيل القطبين السالب والموجب. في نهاية المطاف "تموت" البطارية، حين تفقد القدرة على إنتاج الشحنات على القطبين. وهذا التدهور بطيء في البطاريات القابلة لإعادة الشحن، ومن الممكن عكس التفاعلات الكيميائية التي تحدث مرات عديدة قبل أن يؤثر تدهور المواد على البطارية.
عندما لا تسمح المواد المستخدمة لصُنع الشحنات على الكاثود بتدفق الإلكترونات بسهولة، فغالباً ما يُضاف الكربون للمساعدة في تدفق الشحنة الكهربائية أثناء التفريغ (وإعادة الشحن، إذا كانت بطارية قابلة لإعادة الشحن).
ما الجديد مع الألومنيوم؟
يُشكل الألومنيوم، في بطاريات الألومنيوم (Aluminum batteries)، القطب السالب أو الأنود. وقد طال السعي للحصول هذه البطاريات، نظراً لما يُعرف عن الألومنيوم من قدرة على التخلي عن ثلاثة إلكترونات، وهذا مقدار كبير من الشحنة لكل أيون يدخل في المحلول. إلا أنه لم يسبق أبداً وأن كان أداء بطاريات الألومنيوم جيداً. إذ على الرغم من أنها تنتج شحنة جيدة، فإن الكاثودات تتدهور بسرعة مسببة انخفاضاً في الجهد وقِصر العمر.
لقد وجد فريق من الباحثين وسيلةً لإصلاح هذه المشكلة. وكان ابتكارهم ذو شقين: اختيار محلولهم (مصنوع من محلول أيوني يحتوي على كلوريد الألومنيوم الثلاثيaluminum trichloride 1-ethyl-3-methylimidazolium chloride)، والبنية المادية للكاثود (بدلاً عن نوع المواد). وبدلاً من استخدام الغرافيت (graphite) النموذجي (وهو الكربون)، فقد استخدموا رغوة غرافيتية (graphitic foam).
علينا أولاً النظر، كما فعل المخُتَبِرون، في الغرافيت المتحلل حرارياً (pyrolytic graphite)، المصنوع من ألواح منظمة جداً من جزيئات الكربون المتراصة في طبقات فوق بعضها البعض، مع بعض الروابط التساهمية (covalent bonding) بين الطبقات.
ويتفاعل الألومنيوم مع المحلول على النحو التالي:
\(Al+7AlCl4-→4Al2Cl7-+3e-\)
تُدمج الأيونات في المحلول بين طبقات جزيئات الكربون، وهي عملية تسمى "الإقحام" (intercalating)
\(Cn+AlCl4-→Cn[AlCl4]+e-\)
هكذا تُضبط الأشياء قبل تـوصيل القطبين.
إن كاثود الكربون المتشابك مع جزيئات \(AlCl4\)، ليس مشحوناً بشحنة موجبة، لكنه يوفر مكاناً جيداً لتُدفع الإلكترونات إليه. وعند توصيل قطبي البطارية، تتدفق الإلكترونات من أنود الألومنيوم ذي الشحنة السالبة إلى الكاثود. وسيسمح الكربون للإلكترونات بالتدفق، لترتبط مع جزيء \(AlCl4\) من أجل تشكيل أيون \(AlCl4\) باستطاعته العودة إلى المحلول. وهذا ما يسمى "الرجوع عن الإقحام" (de-intercalation).
عند توصيل لوح الألومنيوم (الأنود) بطبقات الغرافيت (الكاثود)، تتدفق الإلكترونات من الأنود بحرية إلى الكاثود، عاكسة تفاعل الإقحام المذكور أعلاه.
\(Cn[AlCl4]+e-→Cn+AlCl4-\)
وجد العلماء أن أيونات( \(AlCl4¯\))، التي يبلغ عرضها 52.8 بليون جزء من المتر، تَعلقُ أحيانا بين طبقات الغرافيت التي تبعد عن بعضها البعض حوالي 57 بليون جزء من المتر، مما يؤثر على إعادة الشحن. لذلك قرروا تجربة بنية مبتكرة. فصنعوا قاعدة رغوية (foam base) وغلفوها بـ "سبلات" (whiskers) الغرافيت. وتبدو أدناه صورة لها التُقطت بواسطة "مجهر المسح النفقي" (scanning tunneling microscope). وتتيح الرغوة الإقحام والتراجع عن الإقحام بشكل أفضل.
هناك بعض الأشياء الجيدة عن هذه البطارية، منها أنها تستطيع التفريغ كلياً في أقل من 60 ثانية، أو بالتدريج لأكثر من ساعة ونصف لبطارية الغرافيت المتحلل حرارياً، و34 دقيقة لبطارية الرغوة. ويمكن إعادة شحن البطارية في أقل من 60 ثانية لأكثر من 7500 مرة في حدود 98٪ من السعة الكاملة لبطارية الغرافيت المتحلل حرارياً، ولـ 100٪ من سعة بطارية الرغوة! هذه القدرة على إعادة الشحن أفضل بكثير من قدرة بطارية الليثيوم أيون في هاتفك، التي يستغرق شحنها بعض الوقت، والتي لا يمكن إعادة شحنها بشكل فعال لأكثر من 1000-3000 مرة، وحتى هذا لا يقترب أبداً من سعتها الابتدائية. الميزة الأخرى، أن البطاريات هي قوالب مرنة يمكن ثنيها دون أن تتعرض للتلف. كما أنها لا تحترق، وهو الأمر المثير للقلق في بطاريات الليثيوم. ولكن من المهم أن نؤكد على أن هناك قيوداً أيضاً.
بعض القيود
تعاني هذه التقنية الجديدة من قيود يمكن التغلب عليها في المستقبل، ولكنها بالتأكيد لن تمنع توظيفها في الوقت الراهن. فنطاق جهدها الأقصى يتراوح بين 2 و2.5 فولت، بينما يصل جهد بطاريات الليثيوم أيون إلى حوالي 3.5 فولت. وهذا يعني أنه ستكون هناك حاجة لسلسلة من بطاريات الألومنيوم لجهد يزيد عن 2.5 فولت.
هناك معيار مهم آخر للبطارية، هو مقدار الطاقة التي تستطيع تخزينها لكل غرام. ولقد تبين أن بطارية الألومنيوم الجديدة تستطيع تخزين فقط ما يقارب ربع الطاقة التي تستطيع بطارية الليثيوم أيون تخزينها لكل غرام، لذلك، فقد تصبح قوالب بطاريات الهواتف وأجهزة الكمبيوتر، أو السيارات، غير عملية نوعا ما.
وفيما يلي فيديو يعرض البطارية الجديدة وبعض مميزاتها.
مزيد من الأبحاث والتطبيقات
لقد سبقت الإشارة إلى أن هذه البطاريات قد تكون مفيدة جداً في التخزين المؤقت وإطلاق الطاقة بسرعة على الشبكة الكهربائية، لضمان التدفق المستمر والثابت للطاقة. وحقيقة أن هذه البطاريات يمكن شحنها وتفريغها بسرعة كبيرة، وأنه من الممكن إعادة شحنها مرات كثيرة، يجعلها مثالية لهذا النوع من الاستخدام.


