كان هذا الطرح فلسفيًا إلى حدّ كبير، ولم يفترض العلماء إلى أن ظهرت النظرية الذرية والكيمياء الحديثة أنّ اجتماع الجزيئات مع بعضها يؤلف البنية الأساسية لكل الأشياء. سميت بالجزيئات (molecules)، وهي كلمة من أصل لاتيني حيث (moles) تعني الكتلة mass أو الحاجز barrier. ولكن استخدامها في سياق نظرية الجسيمات الحديثة، يشير إلى وحدات صغيرة من الكتلة.
تعريفها
من خلال تعريفها التقليدي، فإنّ الجزيئات هي الجزء الأصغر من المادة الذي يحتفظ بالخصائص الكيميائية والفيزيائية للمادة. وهي تتألف من اثنتين أو أكثر من الذرات، وتتحد مجموعة من الذرات المتماثلة أو المختلفة مع بعضها البعض بروابط كيميائية.

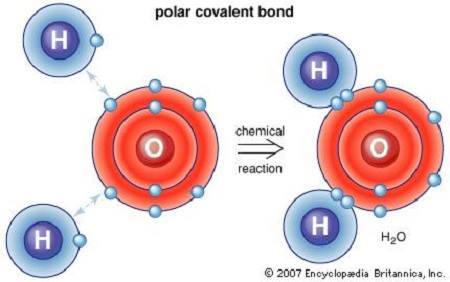
قد تتألف الجزيئات من عنصر كيميائي واحد، كجزيء الأوكسجين O2، أو من عناصر مختلفة، كما هو الحال مع جزيء الماء H2O. وكمكونات للمادة، فالجزيئات موجودة في المواد العضوية (وبالتالي في الكيمياء الحيوية) وهي ما تؤدي إلى العناصر المشكّلة للحياة، كالماء السائل والهواء الممكن تنفسه.
أنواع الروابط
ترتبط الجزيئات مع بعضها بإحدى نوعين من الروابط، تساهمية أو شاردية. والتساهمية (التشاركية) هي الرابطة التي تشترك فيها الذرات بالأزواج الإلكترونية. إذ تتشكل الرابطة نتيجة توازن مستقر لقوى الجذب والتنافر بين الذرات.
وعلى النقيض من ذلك، فالروابط الشاردية تنطوي على التجاذب الكهربائي بين الشوارد المتعاكسة بالشحنة. والشوارد التي تقوم بمثل هذا النوع من الروابط هي ذرات فقدت إلكترونًا أو أكثر (أصبحت ذات شحنة موجبة وهي تدعى بالكاتيونات cations أو الشرجبات)، والتي اكتسبت إلكترونًا أو أكثر (أصبحت ذات شحنة سالبة وتدعى أنيونات anions أو شرسبات). وبخلاف التشارك، يطلق على هذا الانتقال اسم التكافؤ الإلكتروني.
وبأبسط الصيغ، تتشكل الروابط الشاردية بين ذرة معدنية (كاتيون) وذرة لامعدنية (أنيون)، لتنتج مركبات من مثل كلوريد الصوديوم Nacl أو أكسيد الحديد \(Fe^2O^3\) (الملح والصدأ). إلا أنّ تراكيب أكثر تعقيدًا يمكن الحصول عليها من الرابطة التساهمية، كالأمونيوم \(NH^{+4}\) والهيدروكربونات كالميتان\( CH^4\) و الإيتان \(C^2H^6\) .
تاريخ دراسة الجزيئات
تاريخيًا، تشابكت النظرية الجزيئية والنظرية الذرية. والإشارة الأولى إلى أنّ المادة مؤلفة من (وحدات مصانة) بدأت في الهند القديمة حين تبنّى ممارسوا الطب في اليانية Jainism الفكرة القائلة بأن كل الأشياء مؤلفة من عناصر صغيرة غير قابلة للقسمة تؤلف باتحادها أجسامًا أكثر تعقيدا.
وفي اليونان القديمة، صاغ الفيلسوفان ليوسيبوس Leucippus و ديمقرطيس Democritus مصطلح "atomos الذرات" للإشارة إلى أصغر أجزاء المادة غير القابلة للتقسيم، والتي اشتققنا منها اللفظ الحديث "الذرة atom".
وفي العام 1661، جادل عالم الطبيعيات روبرت بويل Robert Boyle في مقال عن الكيمياء، تحت عنوان "الخيميائي المتشكك" بأنّ المادة مؤلفة من تراكيب مختلفة من الجسيمات "corpuscules" غير التراب والهواء والرياح والماء والنار. إلا أنّ هذه المشاهدات كانت محصورة في مجال الفلسفة.
ولم توضع الذرات والجزيئات موضع العلم الجاد حتى أواخر القرن الثامن عشر وأوائل القرن العشرين وذلك مع قانون حفظ الكتلة Law of Conservation of Mass لأنطونيو لافوازيه Antoine Lavoisier وقانون النسب المضاعفة Law of Multiple Proportions لدالتون Dalton. وكان السابقون قد اقترحوا أنّ العناصر هي المواد الأساسية التي لا يمكن تقسيمها إلى أجزاء أصغر في حين اقترح اللاحقون بأن كل عنصر يتألف من نمط وحيد وفريد من نوعه من الذرات، هذه العناصر يمكنها الارتباط مع بعضها لتشكل المركبات الكيميائية.

وحلت نعمة جديدة في العام 1865 حين قام يوهان جوزيف لويشميث Johann Josef Loschmidt بقياس حجم الجزيئات التي تؤلف الهواء، ما أعطى تصورًا وإدراكًا عن حجم الجزيئات. وسمح اختراع (STM) مجهر المسح النفقي Scanning Tunneling Microscope في العام 1981 بمشاهدة الذرات والجزيئات مباشرة وللمرة الأولى أيضًا.
واليوم، أصبح مفهومنا عن الجزيئات مصقولًا ويعود الفضل في ذلك إلى الأبحاث الجارية في مجال فيزياء الكم، والكيمياء العضوية والكيمياء الحيوية. وحين التطرق إلى البحث عن أشكال أخرى للحياة في عوالم اخرى، يصبح من الضروري فهم متطلبات نشوء الجزيئات العضوية من مجموع اللبنات الكيميائية.

